-
 News - 20 April 2024, 01:14
News - 20 April 2024, 01:14Kejagung Telusuri Informasi Jet Pribadi di Singapura Diduga Milik Harvey Moeis
-
 Ramadhan - 20 April 2024, 00:40
Ramadhan - 20 April 2024, 00:40Kualitas Hidup Anak-Anak Yatim, Piatu dan Dhuafa Dinilai Perlu Diperhatikan
-
 En - Saturday, 20 April 2024, 00:37
En - Saturday, 20 April 2024, 00:37Democrat Party Proposes AHY to be Prabowo Minister
-
-
 Retizen - 20 April 2024, 00:35
Retizen - 20 April 2024, 00:35Dinamika Modal Sosial Lokal terhadap Globalisasi
-
 Ameera - 20 April 2024, 00:35
Ameera - 20 April 2024, 00:35Sopir Bus Ketiban Rezeki Rp 100 Juta, Apakah Balasan Kebaikan dari Allah SWT Selalu Uang?
-
-
 Internasional - 20 April 2024, 00:35
Internasional - 20 April 2024, 00:35Beijing: Veto AS di DK PBB Hancurkan Impian Rakyat Palestina
-

-
 News - 20 April 2024, 00:26
News - 20 April 2024, 00:26MK Panggil Para Pihak Hadiri Sidang Putusan Sengketa Pilpres Pada Senin
-
-
 News - 20 April 2024, 00:24
News - 20 April 2024, 00:24TKN Imbau Pendukung Prabowo-Gibran tak Gelar Aksi Saat MK Bacakan Putusan
-
 News - 20 April 2024, 00:15
News - 20 April 2024, 00:15Prabowo Larang Pendukung Demonstrasi, Pengamat: Sudah Tepat, Arif dan Bijaksana
-
 En - Saturday, 20 April 2024, 00:04
En - Saturday, 20 April 2024, 00:04Prabowo Asks His Supporters not to Take Action
-
-
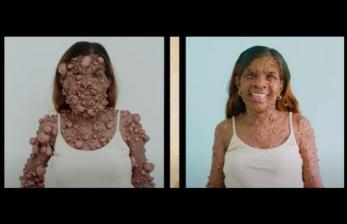
 Ameera - 20 April 2024, 00:03
Ameera - 20 April 2024, 00:03'Tumor Gelembung' Juga Bisa Diwariskan, Seberapa Besar Peluang Orang Menderitanya?
-
 Islam Digest - 20 April 2024, 00:02
Islam Digest - 20 April 2024, 00:02Keutamaan Memuliakan Anak Yatim
-
 News - 19 April 2024, 23:59
News - 19 April 2024, 23:59Tiga Bocah Hanyut Terseret Ombak di Pantai Damas Trenggalek, Satu Diantaranya Tewas
-
 Ekonomi - 19 April 2024, 23:51
Ekonomi - 19 April 2024, 23:51Indonesia Bakal Jadi Tuan Rumah APEC SMEWG, Bahas Masa Depan UMKM
-
-
 Visual - 19 April 2024, 23:50
Visual - 19 April 2024, 23:50Tradisi Ngadu Bedug di Pandeglang
-
 News - 19 April 2024, 23:43
News - 19 April 2024, 23:43Pemkab Bogor Tingkatkan Target Kunjungan Wisatawan Hingga 12 Juta Orang pada 2024
-
 Ekonomi - 19 April 2024, 23:41
Ekonomi - 19 April 2024, 23:41Kemendag Sebut Pembelian Produk Lokal di e-Commerce Naik
-
 News - 19 April 2024, 23:40
News - 19 April 2024, 23:40Nyalon Walikota Kendari, Tri Febrianto Utus Dua Sosok Ini Ambil Formulir Pendaftaran
-
 News - 19 April 2024, 23:39
News - 19 April 2024, 23:39Gunung Ruang Erupsi, Warga Pulau Tagulandang di Radius Bahaya Perlu Dievakuasi
-
 News - 19 April 2024, 23:29
News - 19 April 2024, 23:29Target 41 Ribu Ton, Bulog Cirebon Genjot Pengadaan Beras
-
 Ameera - 19 April 2024, 23:27
Ameera - 19 April 2024, 23:27Musisi Indonesia Gelar Aksi Damai Tuntut Hentikan Genosida Gaza
-
-
 Ekonomi - 19 April 2024, 23:27
Ekonomi - 19 April 2024, 23:27Cegah Terulangnya Peristiwa Sipadan-Ligitan, BI Genjot Ekspedisi Rupiah Berdaulat
-
 Visual - 19 April 2024, 23:20
Visual - 19 April 2024, 23:20IBL: Prawira Harum Bandung Kalahkan Bali United Basketball.
-
 Sharia - 19 April 2024, 23:19
Sharia - 19 April 2024, 23:19Sukuk Ritel Cocok Jadi Pilihan untuk Investor Pemula, Ini Alasannya
-
 News - 19 April 2024, 23:17
News - 19 April 2024, 23:17Pemkot Madiun Waspada Potensi Bencana Dampak Cuaca Ekstrem
-
 Ekonomi - 19 April 2024, 23:15
Ekonomi - 19 April 2024, 23:15Dirjen Migas: Konflik Iran-Israel Diyakini tak Ganggu Cadangan BBM Nasional
-
 Video - 19 April 2024, 23:12
Video - 19 April 2024, 23:12Keistimewaan Melaksanakan Qiyamul Lail di Masjidil Haram
-
 Ekonomi - 19 April 2024, 23:11
Ekonomi - 19 April 2024, 23:11Fundamental Ekonomi RI Dinilai Kuat Tahan Pelemahan Rupiah
-
-
 Network - 19 April 2024, 23:11
Network - 19 April 2024, 23:11BPKH Gandeng BRI Distribusikan Uang Saku Jamaah Haji Rp 665 Miliar
-
 Ekonomi - 19 April 2024, 23:00
Ekonomi - 19 April 2024, 23:00Indodax Tegaskan Cegah Tindak Pencucian Uang Melalui Aset Kripto
-
 Network - 19 April 2024, 22:59
Network - 19 April 2024, 22:59Terapi Radiasi untuk Pengobatan Kanker: Manfaat dan Efek Sampingnya
-
 News - 19 April 2024, 22:59
News - 19 April 2024, 22:59Erupsi Gunung Ruang Sebabkan 14 Penerbangan di Bandara Hasanuddin Dibatalkan
-
 Ekonomi - 19 April 2024, 22:49
Ekonomi - 19 April 2024, 22:49Kemendag Sebut Revisi Permendag Pengaturan Impor Selesai Pekan Depan
-
 Visual - 19 April 2024, 22:45
Visual - 19 April 2024, 22:45Jembatan Putus Akibat Banjir Lahar Hujan Gunung Semeru
-
 Ameera - 19 April 2024, 22:32
Ameera - 19 April 2024, 22:328 Kesalahan yang Dilakukan Saat Traveling Beramai-ramai
-
 Internasional - 19 April 2024, 22:29
Internasional - 19 April 2024, 22:29Israel Serang Iran, Sekjen PBB Kutuk Siklus Saling Balas
-
 En - Friday, 19 April 2024, 22:26
En - Friday, 19 April 2024, 22:26LSI Survey: Attorney General Gains Highest Public Trust
-
 Ekonomi - 19 April 2024, 22:25
Ekonomi - 19 April 2024, 22:25Nasabah KUR BRI Ini Panen Penjualan Selama Ramadhan dan Lebaran
-
 Ekonomi - 19 April 2024, 22:20
Ekonomi - 19 April 2024, 22:20Waskita Beton Suplai Produk untuk Proyek Pertamina Hulu Sanga Sanga
-
 Retizen - 19 April 2024, 22:18
Retizen - 19 April 2024, 22:18Pesatnya Kemajuan Ekonomi Industri Halal di Indonesia
-
 Rejogja - 19 April 2024, 22:14
Rejogja - 19 April 2024, 22:14Pameran Ekonomi Kreatif Digelar di Plaza Kuliner Glagah Kulon Progo
-
 Ameera - 19 April 2024, 22:14
Ameera - 19 April 2024, 22:14God Bless Rilis Album Anthology dalam Format Vinil Berisi 11 Lagu dan 1 Medley
-
 Ekonomi - 19 April 2024, 22:13
Ekonomi - 19 April 2024, 22:13BRI Optimistis Tahun Ini Capai Target Penyaluran KUR
-
 Khazanah - 19 April 2024, 22:10
Khazanah - 19 April 2024, 22:10Kemenag Perkuat Akselerasi Pengembangan Zakat dan Wakaf di Indonesia
-
 Network - 19 April 2024, 22:10
Network - 19 April 2024, 22:10Sejarah Hari Ini: Stasiun Luar Angkasa Pertama Dunia Diluncurkan ke Orbit
-
 Sharia - 19 April 2024, 22:06
Sharia - 19 April 2024, 22:06Meriahkan Ramadhan, BSI Maslahat Sebar Kebaikan Hingga Rp 11,24 Miliar
-
 Visual - 19 April 2024, 22:05
Visual - 19 April 2024, 22:05Petugas Haji Daerah Mendapatkan Vaksin Meningitis
-
 Tekno - 19 April 2024, 22:01
Tekno - 19 April 2024, 22:01Ahli Sebut Penyebab Banjir Dubai karena Perubahan Iklim
-
 Network - 19 April 2024, 22:00
Network - 19 April 2024, 22:00Imam Masjid Istiqlal Prof Nasaruddin Umar: Maknai Luasnya Arti Silaturahmi
-
 Ekonomi - 19 April 2024, 21:57
Ekonomi - 19 April 2024, 21:57Digitalisasi Makin Terasa, BRI Lanjutkan Model Bisnis Hybrid Bank
Terpopuler
Advertisement